“知” を結集し課題を解決
医薬品 / 医療機器の生産施設で品質を守るために、国内外のトップコンサルタントによる “知” を結集し、GMDP (GMP&GDP)/QMS/薬事 の観点でコンサルティングサービスを提供しています。
*GMP:Good Manufacturing Practice
*GDP:Good Distribution Practice
*QMS:Quality Management System
シーエムプラスの GMDP/QMS/薬事 コンサルティングのつよみ
“知” の結集、各分野のトップコンサルタント
CM Plus(シーエムプラス)は社内だけではなく、国内外のトップコンサルタントと提携。
医薬品、医療機器、再生医療等製品における、製造を始め、QC、QA、薬事、さらには査察通訳等、各分野の専門コンサルタントが控えています。
それらの力を課題解決に向ける統括力がCM Plusのつよみです。
日本最大級の GMP 関連情報発信サイト運営にみる“知”の求心力
CM Plusは医薬品・医療機器に携わる皆様を中心に 12,000 人以上が会員登録する日本最大級の GMP 関連薬事規制情報発信サイト「GMP Platform」を運営しています。
CM Plusには GMDP/QMS/薬事 関連の” 知” が常に集まる求心力があります。
供給者監査、品質改善、査察、人材育成まで。実践的なサポート体制
製品および生産施設のライフサイクルによりそい、供給者監査、品質改善、査察支援、施設に携わる人材の育成までを一貫してサポート。
実践的な品質づくりを強く支えています。
シーエムプラスの 薬事コンサルティング
シーエムプラスの薬事コンサルティングは、製薬業界での実務経験の豊富な薬事コンサルタントがお客様のご要望に併せたコンサルティングサービスを提供します。
シーエムプラスの GMDP/QMS コンサルティング
対応範囲
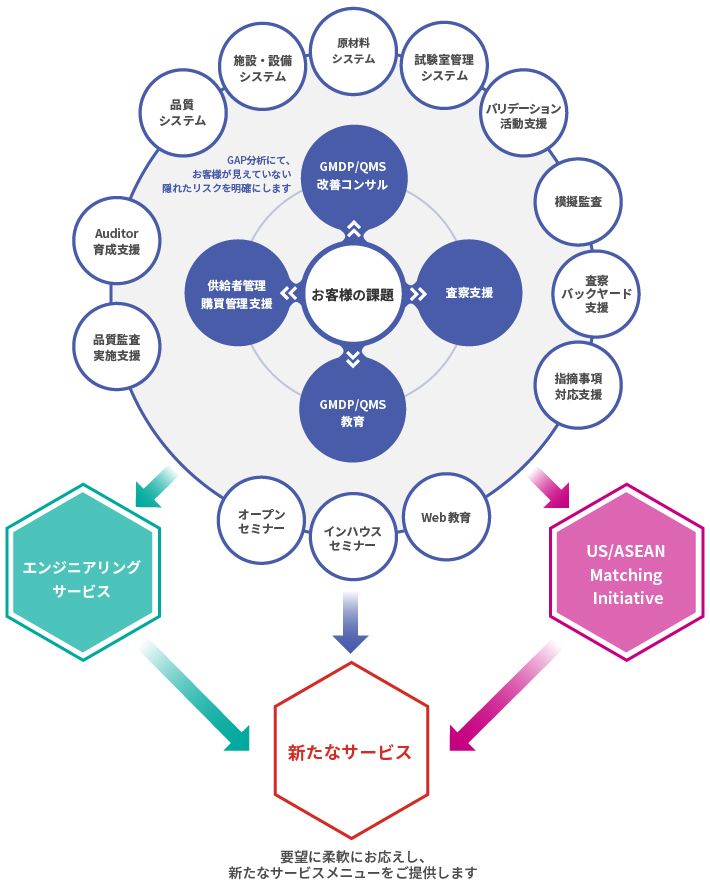
医薬品GMDPコンサルティング
GMDP改善、査察支援、GMDP教育訓練、供給者管理/購買管理支援、その他、M&A業務支援等
医療機器QMSコンサルティング
QMSの継続的改善、医療機器業界への新規参入支援
再生医療領域開発支援コンサルティング
再生医療等製品/特定細胞加工物の品質システム構築支援、施設・設備診断/構築支援
海外工場支援・M&A支援・査察/監査通訳
ベトナム、インドネシア、中国、ミャンマー、インド、シンガポール等
品質づくり、このような希望はありませんか?
-
■規制当局の査察に備えたい
-
■品質システムの構築/改善を具体的に進められるパートナーがほしい
-
■製造施設に潜む問題やリスクに対する不安を払拭したい
-
■外部委託先の製造工場や原材料供給元の監査を担当する人材がほしい
-
■異業種から医薬品・医療機器業界への新規参入において薬事規制をガイドしてくれるパートナーがほしい
シーエムプラスのコンサルティングなら
-
■規制当局の元査察官や日米欧の査察経験者が実際の査察と同じ進行で模擬査察を行い、指導・改善提案をいたします。
-
■PQSの構築や改善、原材料の保管管理や施設の導線改善、現場の運用改善などに関する改善提案を総合的な視点で行います。社内にエンジニアリングのコンサルタントがいるため、施設の改善提案がスムーズにできることも強みです。
-
■GAP分析を実施することにより、まずは製造所の「現実の姿」と「今後の望ましい姿」との差異(ギャップ)を明確にします。設備・施設と品質システムの両面から、隠れたリスクを含めた課題を洗い出し、改善提案を行います。
-
■日本の製薬企業向けの体系的なGMP Auditor育成プログラムを提供しています。また、経験豊富なコンサルタントをAuditorとして派遣します。海外監査における通訳の手配も可能です。
-
■薬事規制の高い壁、最新の薬事規制ガイドラインの主旨をひもといた解説が、初任者や初心者にもわかりやすいと好評です。
お客様の声
 |
|---|
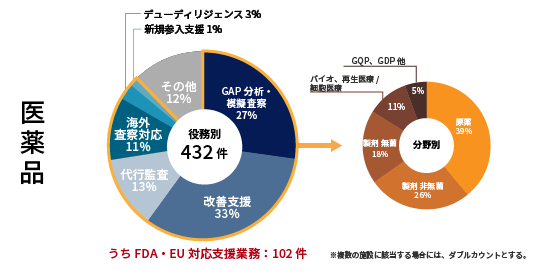
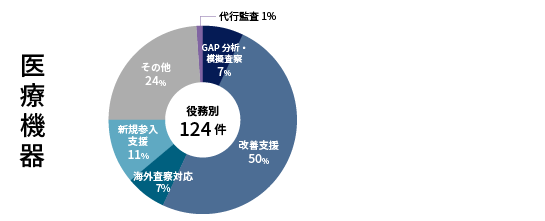
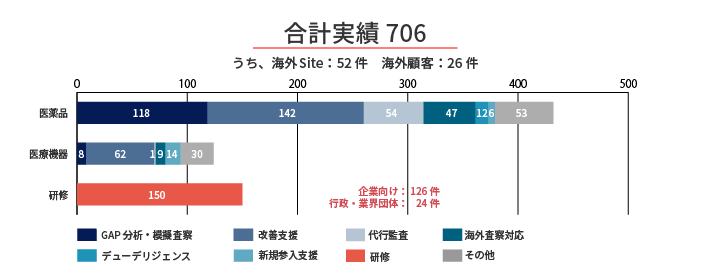
実績
<2011年~2023年3月>